Il 7 ottobre è stato assegnato il premio Nobel per la Fisiologia e Medicina ai ricercatori William G. Kaelin Jr (1957), Sir Peter J. Ratcliffe (1954) e Gregg L. Semenza (1956) «per le loro scoperte sulla capacità delle cellule di rilevare e adattarsi alla disponibilità di ossigeno».

Il premio, istituito il 27 novembre 1895, prende il nome dal testamento del ricco imprenditore Alfred Nobel, famoso per aver brevettato la dinamite ad uso sia industriale che bellico.
La nascita del premio Nobel è circondata da una storia macabra quanto divertente: nel 1888 alla morte di Ludvig, il fratello di Alfred Nobel, alcuni giornalisti confusero i due fratelli e titolarono il necrologio con la frase «Le marchand de la mort est mort» («Il mercante della morte è morto»). Alfred, al leggere quelle righe, decise di lasciare un miglior ricordo di sé ai posteri, devolvendo una parte della sua cospicua eredità per cinque premi legati al suo nome, assegnati annualmente, «a coloro che, durante l’anno precedente, abbiano dato il più grande contributo all’umanità» nell’ambito della Chimica, della Fisica, della Fisiologia e Medicina, della Letteratura e infine della Pace (nel 1969 la Banca del Regno di Svezia ha deciso di istituire un fondo per garantire l’aggiunta di un Nobel per l’Economia).

In osservanza delle ultime volontà del signor Nobel, quest’anno l’ambito premio è stato assegnato a tre ricercatori, che si sono distinti per le loro scoperte sulla fisiologia dell’adattamento cellulare alla normossia e all’ipossia, ovvero a stati normali o diminuiti di ossigeno a livello cellulare e tissutale. Precedenti premi conferiti per scoperte che riguardano questa piccola molecola (O2) e il suo ruolo nel metabolismo delle cellule risalgono al 1931 per la scoperta del suo ruolo come produttore di energia, al 1938 per i meccanismi della respirazione e al 1955 per la scoperta degli enzimi ossidativi.
L’ossigeno è infatti il più importante “carburante” delle nostre cellule a opera dei mitocondri, organelli cellulari presenti nelle nostre stesse cellule. I mitocondri agiscono come vere e proprie “centraline elettriche”: sono cioè in grado di produrre l’energia di cui abbiamo bisogno.
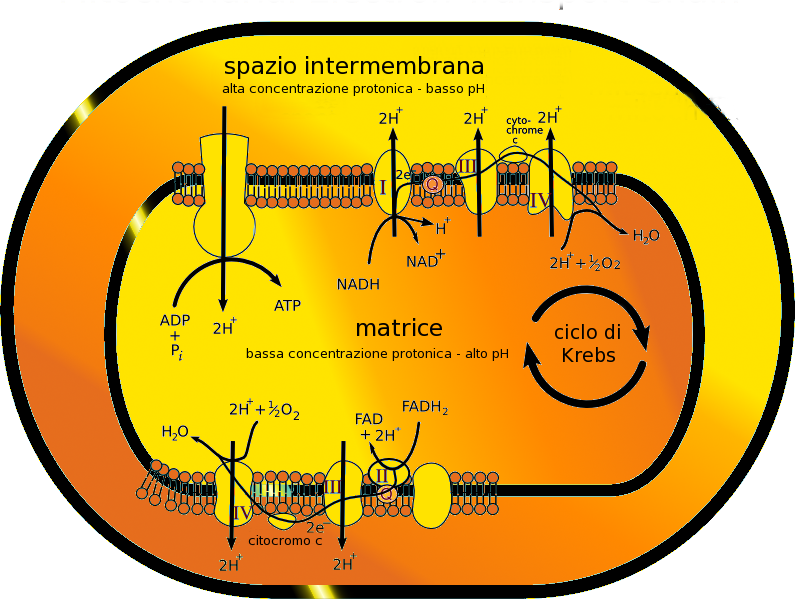
Ma la quantità di ossigeno presente nel sangue e nel corpo non si mantiene costante nel tempo: cambia nello sviluppo del corpo umano dall’embriogenesi e può variare in seguito a una lesione, se viene interrotta la vascolarizzazione, o nell’intero corpo per effetto dell’altitudine e della rarefazione dell’ossigeno nell’aria.
Le cellule adattano il proprio utilizzo energetico in base alla quantità di ossigeno presente. In caso di ipossia (bassi livelli di ossigeno) la cellula risponde inviando al rene un segnale che aumenta la produzione di eritropoietina (EPO), un ormone che si occupa di regolare la produzione di globuli rossi da parte del midollo osseo.

(Da qui parte lo spiegone, se vuoi saltarlo, puoi procedere a dopo la foto del pathway molecolare)
L’EPO è stata studiata in primis da Semenza per comprendere quali meccanismi si attivassero in seguito a ipossia ed ha osservato come la sua produzione fosse dovuta all’espressione di geni presenti nell’hipoxia response element (HRE).
L’attivazione di HRE è regolata da un complesso proteico (ovvero due proteine assemblate) ARNT, sempre presente nella cellula e HIF-1alfa che è ossigeno-dipendente.
HIF-1alfa è infatti costantemente presente nella cellula, ma in presenza di O2 viene degradata e non attiva HRE. In caso di ipossia invece, si accumula nel nucleo e legandosi a ARNT permette l’attivazione di HRE.
Kaelin nel 1995 studiando pazienti affetti dalla sindrome di Von Hippel-Lindau (VHL), ovvero una condizione genetica che porta a una maggiore predisposizione allo sviluppo di tumori già in giovane età, ha osservato come la mancanza della proteina VHL portasse ad una maggior espressione dei geni indotti dall’ipossia (sempre HRE).
Fu Sir Ratcliffe a dimostrare l’importanza della presenza di VHL: senza questa proteina HIF-1alfa non può essere idrossilata e successivamente eliminata.
L’HRE è una zona del DNA che contiene centinaia di geni che attivano risposte come l’angiogenesi (la produzione di nuovi vasi sanguigni), potenziano la vascolarizzazione già presente, inducono cambiamenti metabolici e la produzione di EPO e influenzano la possibilità di sopravvivenza o l’apoptosi, il “suicidio cellulare”, nonchè la riproduzione della cellula stessa.
La scoperta del ruolo fondamentale di HIF-1alfa nell’indurre l’attivazione di HRE, del ruolo di VHL e dell’idrossilazione in presenza di normossia e le loro possibili applicazioni nella pratica clinica ha stabilito l’assegnazione del Premio Nobel ai tre ricercatori.
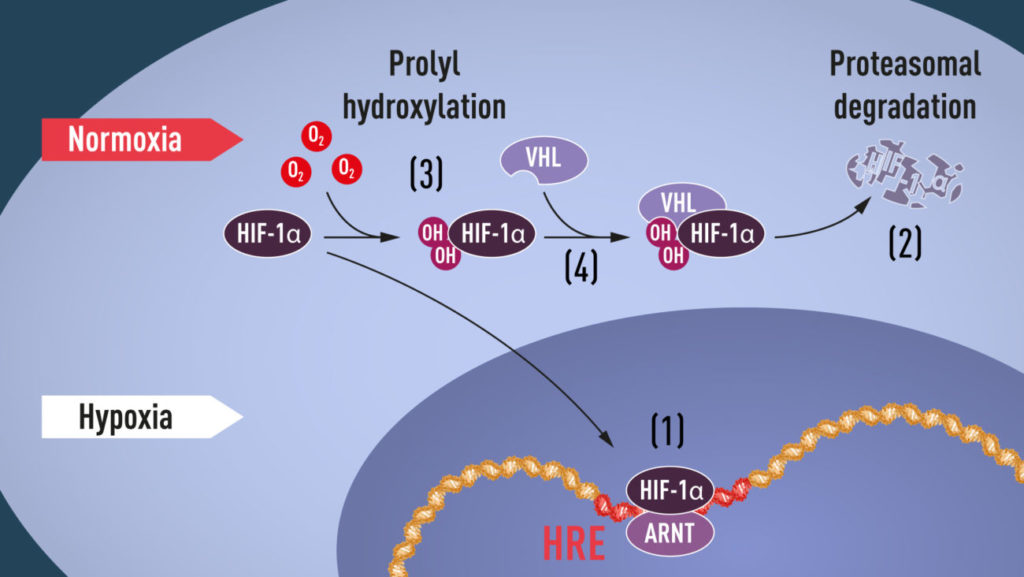
Tutto chiaro e lampante? Forse no. Immaginiamola come una catena di montaggio: ogni proteina presente e l’ossigeno stesso servono a segnalare alla cellula che tutto procede bene ovvero che la quantità di O2 è sufficiente. In questo caso HIF-1alfa viene prodotta e subito eliminata, se invece la cellula si ritrova in carenza di ossigeno la catena si interrompe e HIF-1alfa con ARNT si attivano e intervengono sul DNA attivando HRE.

Questa scoperta è fondamentale in quanto HIF-1alfa regola quasi ogni aspetto della fisiologia del metabolismo, dall’esercizio all’embriogenesi, la risposta immune, l’adattamento all’altitudine, la respirazione. Dal punto di vista fisiopatologico è coinvolta in numerose patologie come l’anemia, il cancro, l’infarto, le infezioni, la guarigione delle ferite, l’infarto miocardico.
Ciò rende tutta questa difficile spiegazione più vicina al paziente: quali farmaci e per quali patologie potrebbe essere utile questa scoperta?
Oltre ad essere già entrata nei libri di testo di giovani aspiranti medici, biologi e biotecnologi, questa scoperta potrebbe modificare il trattamento di alcune patologie come alcuni tipi di tumori e l’anemia. Per alcuni tipi di tumori potrebbero esser utili farmaci che diminuiscano l’attività di HIF-1alfa, mentre per altre patologie come l’anemia, ovvero la carenza di globuli rossi, il paziente può trarre giovamento dall’aumento dell’attività di HIF-1alfa.
Come dichiarato durante l’assegnazione del premio Nobel, sono già in uso in Cina dei farmaci per il trattamento delle anemie, i cosiddetti HIF stabilizers che sono in fase III di studio in occidente. Per il futuro si possono immaginare farmaci che agiscano inibendo HIF-1alfa per il trattamento di determinati tumori.
Le nostre cellule possono essere viste come candele che bruciano, in un delicato equilibrio in continuo mutamento, appeso a un filo dell’aria che respiriamo.